Персонализированные мини-органы могут ускорить лечение редких заболеваний
Десятки тысяч младенцев рождаются каждый год с загадочными заболеваниями, вызванными генетическими мутациями, настолько редкими, что никто еще не пытался разработать лечение. Теперь исследователи нашли способ использовать крошечные капли ткани, выращенные из клеток крови пациентов, чтобы ускорить лабораторную работу, необходимую для тестирования персонализированных лекарств для некоторых из этих больных детей. Их исследование, опубликованное в Nature, предполагает, что эти выращенные в лаборатории «органоиды» могут помочь предсказать эффекты лечения генетических препаратов, изготовленных из РНК.
Тестирование индивидуальных РНК-препаратов с использованием тканей, созданных из собственных клеток пациента, «еще не проводилось», говорит биолог развития Мадлен Ланкастер из Лаборатории молекулярной биологии Медицинского исследовательского совета, которая не принимала участия в работе. «Это очень впечатляющее и важное исследование», — говорит она, которое может сократить высокие затраты и ускорить темпы персонализированной медицины.
Руководитель исследования, молекулярный биолог Скотт Янгер из Детского исследовательского института милосердия, был вдохновлен историей Милы, девочки с редким заболеванием мозга под названием болезнь Баттена, которая временно поправилась после того, как исследователи быстро разработали лекарство, адаптированное к ее необычной мутации болезни. Лекарство представляло собой антисмысловой олигонуклеотид (ASO), цепь РНК, которая может исправить мутацию, зашивая дефект в матричной РНК гена, чертеже для построения белка. Янгер хотел разработать адаптированные ASO для пациентов, включенных в инициативу в его институте, которая направлена на секвенирование геномов 30 000 детей с редкими генетическими заболеваниями в течение 7 лет, чтобы определить их мутации, вызывающие заболевание.
Исследователи часто разрабатывают индивидуальные препараты ASO, тестируя их на культивируемых клетках кожи пациента. Вместо этого Янгер хотел преобразовать клетки крови в индуцированные плюрипотентные стволовые клетки (iPS) — незрелые клетки, которые можно превратить в определенные типы клеток, вовлеченные в заболевание человека, например, мозг или мышцы. Его лаборатория подвергала эти клетки воздействию потенциальных препаратов, а затем предсказывала, насколько они могут быть эффективны в этой ткани, основываясь на изменениях в экспрессии генов клеток или других изменениях. Но оплата коммерческой лаборатории для создания iPS-клеток из клеток пациента стоит тысячи долларов и может занять до года, узнал Янгер.
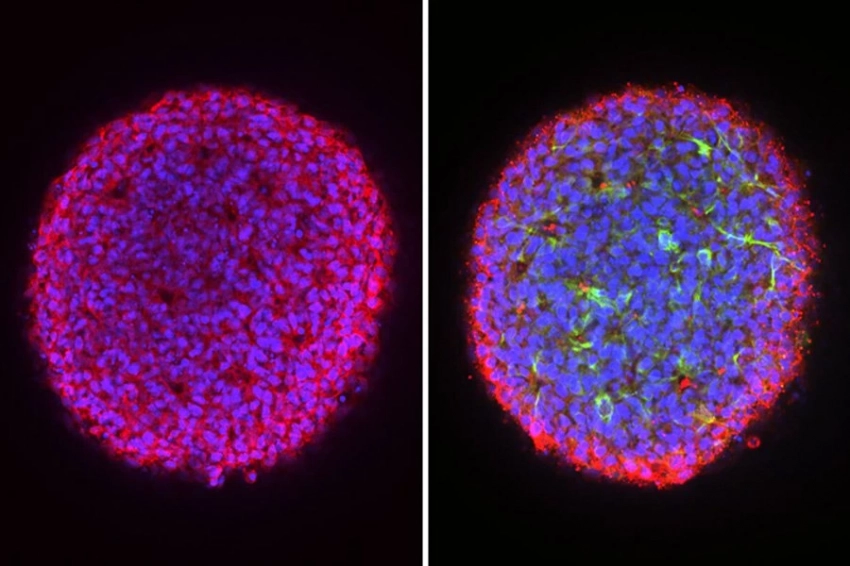
Он решил, что должен быть лучший способ. Поэтому его лаборатория сначала повозилась с коктейлем из химикатов, часто используемых для преобразования клеток крови в iPS-клетки. Исследователи придумали другую формулу, которая сократила этот процесс преобразования с многих месяцев до всего лишь 2 или 3 недель. Затем они использовали больше химикатов, чтобы превратить эти клетки в сгустки мышечной, сердечной или мозговой ткани, которые можно было бы проверить на предмет изменений в функциях, которые могли бы указать, может ли лечение сработать.
Одним из таких методов лечения был одобренный препарат ASO для мышечной дистрофии Дюшенна (МДД), при которой в организме отсутствует белок под названием дистрофин, который является ключевым для функционирования мышц, включая сердце. Когда исследователи добавили этот препарат к органоидам сердца, полученным от пациента с мутацией, на которую он нацелен, они начали вырабатывать дистрофин и перешли от «просто нахождения в чашке» к сокращению, говорит Янгер. Затем его группа создала персонализированные органоиды сердца для двух братьев с МДД, вызванной другой мутацией, для которой отсутствует одобренный препарат. Добавление ASO, настроенного под их мутацию, аналогичным образом заставило органоиды сокращаться, что позволяет предположить, что это также может иметь преимущества, сообщает команда.
Лаборатория Янгера к настоящему времени создала iPS-клетки для более чем 300 пациентов. Помимо изучения индивидуальных ASO, команда также тестирует способность одобренных противосудорожных препаратов успокаивать нейронную активность в органоидах мозга, созданных из клеток пациентов с различными формами эпилепсии. Результаты даже привели к решению о назначении определенного препарата одному пациенту, что уменьшило приступы у ребенка, говорит Янгер. С этой новой платформой органоидов, говорит он, «наши врачи скоро смогут заказать тест через нас, и мы проверим его и дадим им результат» для принятия решений о лечении.
Но органоиды не всегда могут работать для тестирования лекарств, предупреждает Франческо Саверио Тедеско, клиницист-ученый, изучающий редкие мышечные заболевания в Университетском колледже Лондона и Институте Фрэнсиса Крика. В некоторых случаях они могут не имитировать болезнь пациента, потому что, например, ген-виновник не экспрессируется, пока орган не созреет. Тем не менее, он говорит, что статья «станет стимулом и вдохновением для многих исследователей, чтобы делать все больше и больше работы с использованием гуманизированных 3D-культуральных систем для разработки терапии редких заболеваний».
Прямо сейчас новые ASO, которые показывают многообещающие результаты в тестах на клетках, полученных от пациентов, должны пройти дорогостоящие исследования на животных, чтобы убедить регуляторов в их безопасности. Невролог Тим Ю из Бостонской детской больницы, чья команда разработала персонализированный ASO для Милы, считает, что наибольший потенциал новых органоидов может заключаться в снижении необходимости в таких токсикологических исследованиях на животных. Это, безусловно, «самое большое узкое место» для тестирования многообещающего ASO на пациенте, говорит он.
Обсудим?
Смотрите также: